Кислотность воды
Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Это связано с тем, что под действием ионов Н + и ОН — многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение кислотности среды (а так, как клетка состоит из воды на 80%, то — кислотность воды). Природная вода способна сохранять значение рН более или менее постоянным, даже если в неё извне попадает определённое количество кислоты или основания. Если в литр дистиллированной воды внести каплю концентрированной соляной кислоты, то рН понизится с 7 до 4. А если каплю соляной кислоты добавить в литр речной воды с рН=7, показатель почти не изменится. Кислоты и основания, попадающие в природную воду, нейтрализуются растворёнными в ней углекислым газом и гидрокарбонат-ионами: Н + +НСО -3 → Н2О+СО2; ОН — +СО2→ HCO -3 .
Симптомы
Существуют признаки, по которым человек может распознать, что кислотность его желудка повышена.
- Изжога – резкое жжение в области пищевода. Это происходит в результате выброса желудочного сока в пищевод.
- Отрыжка – она обычно возникает, когда человек съел слишком большое количество пищи, но если она имеет кислый или горький привкус, можно однозначно говорить о повышении уровня кислотности.
- Боль в области желудка, которая притупляется во время приема пищи. После того как пища попадает в желудок и начинается процесс переваривания, концентрация кислоты начинает увеличиваться, и она попадает на поврежденные ранее участки слизистой желудка.
- Остальные симптомы повышенной кислотности менее специфичны. То есть они указывают на наличие какой-то патологии в организме, но без других, более характерных признаков, распознать заболевание невозможно. К этим симптомам относится вздутие живота, тошнота, рвота, диарея или запор.
При обнаружении этих признаков стоит незамедлительно обратиться к врачу, чтобы он назначил лечение и объяснил, чем нейтрализовать кислоту и как предупредить ее повышение.
О серной кислоте побольше
Данное вещество — это результат взаимодействия воды с серой. Два атома водорода и кислотный остаток составляют его формулу. Интересно, что способность растворяться в воде без нейтрализации давно используется в промышленности, когда нужно осушить газ.
Кислота забирает на себя воду, оставляя газ нетронутым (за исключением случаев, когда с ним реагирует). При соприкосновении с углеводами тоже происходит необычное – раствор их обугливает. Это объясняется химически: происходит реакция, где углевод отдаёт водород и кислород, а остаётся уголь.
Как кислота, раствор H2SO4 реагирует с метиловым оранжевым, перекрашивая его в красный. Она способна окислять практически все металлы, кроме:
- Золота;
- Алюминия;
- Железа;
- Платиновой группы.

Мнение эксперта
Внимание!
Собственно, именно поэтому H2SO4 всегда перевозят в ёмкостях из стали. После такого напоминания школьного курса становится легче понять, с чем реагируют вещества из этой группы и каковы их особенности
Нейтрализация – один из видов взаимодействия, об особенностях которого нужно узнать подробнее перед её проведением.
Свойства эмульгатора E513
В современной пищевой промышленности добавка E513 используется в качестве стабилизатора. Кроме соединения серы и селитры, в лабораторных условиях производство серной кислоты проводится следующим образом: сначала проводится обжиг железного колчедана, в результате которого на выходе получается соединение серы и водорода. Окисление этого соединения становится причиной образования серного ангидрида, который, растворяясь в воде, дает серную кислоту.
Вещество имеет высокие гигроскопические характеристики. При попадании на бумагу и древесину она вызывает обугливание, а при попадании на человеческую кожу становится причиной ожогов. Такие ее качества являются причиной повышенных требований безопасности при упаковке и перевозке. Пищевую добавку E513 допускается перевозить в таких емкостях:
- стальные контейнеры и бочки;
- емкости из полимеров, заключенные в металлический каркас;
- стальные емкости с прокладками из фторопласта в горловине;
- другие емкости, сделанные из материалов, стойких к влиянию серной кислоты.
Серная кислота для воска
Для очистки и отбеливания воска нередко применяется концентрированная серная кислота. Она сульфирует смолистые продукты, содержащиеся в воске, и переводит их в соединения, отделяемые от него при отстаивании. Наряду с этим протекает частичный гидролиз воска с образованием высших спиртов.
Спирт взаимодействует с серной кислотой, в результате чего получается алкидсульфат, растворимый в воске. При нагревании с водой алкидсульфат гидролизуется, и образуются спирт и серная кислота. Но реакция не идет до конца, поэтому при плохой промывке очищаемого воска алкидсульфат попадает в вощину и при последующем контакте с нектаром вновь образуется кислота.
Обработка от варроатоза пчел растворами или парами органических кислот, хранение суши в контакте с парами уксусной кислоты (с целью профилактики от повреждения молью) также приводят к появлению следов кислот в меде.
Минеральные и органические кислоты каталитически ускоряют реакции превращения гексоз в оксиметилфурфурол (ОМФ). Скорость образования ОМФ из глюкозы и фруктозы неодинакова. Напомним, различные меда отличаются по содержанию гексоз. Кетозы превращаются в ОМФ в 15-20 раз быстрее альдоз. Другими словами, мед, содержащий больше фруктозы, менее устойчив при том же количестве каталитически действующих примесей и в нем интенсивнее накапливается ОМФ.
В пересчете на абсолютно сухой мед процентные соотношения «фруктоза — глюкоза» в различных медах следующие: с гречихи — 56,1-39,9; липы — 45,6-42,7; донника — 56,2-41,7; кориандра — 51,7-42,7. Учитывая различную скорость превращений в ОМФ, потенциальная неустойчивость (Пн) меда с гречихи оказывается следующей:
Пн = 56,1 х 20 + 39,9 х 1 = 1162, где 56,1 — содержание фруктозы в абсолютно сухом меде; 20 — относительная скорость образования ОМФ из фруктозы в условиях кислотного катализа; 39,9 — содержание глюкозы в абсолютно сухом меде; 1 — относительная скорость образования ОМФ из глюкозы.
 Обработка от варроатоза пчел растворами или парами органических кислот, хранение суши в контакте с парами уксусной кислоты (с целью профилактики от повреждения молью) также приводят к появлению следов кислот в меде
Обработка от варроатоза пчел растворами или парами органических кислот, хранение суши в контакте с парами уксусной кислоты (с целью профилактики от повреждения молью) также приводят к появлению следов кислот в меде
Значения Пн для других медов: с липы — 955; донника — 1166; кориандра — 1077. Таким образом, наиболее устойчивым к образованию ОМФ является мед с липы, за ним следуют меда с кориандра, гречихи и донника. Появления ОМФ из-за кислотного воздействия на глюкозу и фруктозу меда можно избежать, поставив под строгий контроль процесс сернокислотной очистки воска (целесообразно проводить анализ воска на наличие сульфогруппы и сульфатиона), методы борьбы с варроатозом (исключение кислот), зрелость меда (исключение закисания), условия хранения суши и меда. В повседневной практике пчеловодам также рекомендуем хорошо промывать вощину, что будет способствовать и сохранению качества меда, и лучшему строительству сотов.
Оценка меда через показатель потнециальной неустойчивости (Пн), полученный из соотношения глюкозы и фруктозы, характеризует лишь склонность меда в присутствии кислот к образованию ОМФ и никак не уменьшает пищевую и лечебную ценность различных медов
И если в меде большое количество фруктозы, то такой мед не вызывает напряжения инсулярного аппарата поджелудочной железы, что важно для людей пожилого возраста. Фруктоза предпочтительна по сравнению с другими сахарами при различных нарушениях обмена веществ, и поэтому мед с донника и другие, богатые ей, особенно полезны при атеросклерозе, нарушениях холестеринового обмена, ожирении, для нормальной работы кишечника, хотя они и более склонны к образованию ОМФ
Глюкоза уже потому необходима, что она входит в состав крови, способствует созданию энергетических запасов в печени в виде гликогена, нормальной деятельности сердечной мышцы. Комплекс целебных действий этих сахаров усилен ферментами, белками, микроэлементами и другими составляющими нектара и пыльцы, принесенных и переработанных пчелой.
Автор подчеркивает, что оксиметилфурфурол появляется в меде не только из-за перегревания при расфасовке и условий хранения. Он возникает из-за кислотного воздействия на глюкозу и фруктозу при плохой очистке воска, из которого делают вощину, при обработках семей от варроатоза кислотами и суши парами уксусной кислоты. Повышенное содержание ОМФ бывает связано с большим количеством фруктозы в меде, объясняющимся его ботанической принадлежностью.
Видео — что делают с химическими отходами
Утилизация кислот – это проблема, остро стоящая для многих предприятий. Такие агрессивные среды даже в малых количествах токсичны для организма человека. Большие объемы этих веществ при попадании в окружающую среду оказывают на нее крайне негативное воздействие
Поэтому важно эти опасные вещества правильно утилизировать
Важно! Известно, что кислоты являются ядовитыми. При неаккуратном обращении с ними, при попадании их на кожу или внутрь организма могут произойти ожоги, сильные отравления и даже летальный исход
Процесс, касающийся утилизации таких агрессивных сред на предприятиях, начинается с емкости, в которой эти вещества перевозятся и хранятся. Требования к таре при утилизации:
- Строго должны соблюдаться условия герметичности тары (она должна быть полностью герметичной), на нее должна быть нанесена специальная маркировка.
- Контейнер должен быть изготовлен из материала, инертного по отношению к перевозимым в нем веществам во избежание повреждения самого контейнера.
- Запрещается осуществлять смешивание разных кислот.
- Транспортировка тары с агрессивными отходами должна производиться специальным транспортом.
Поступившие на переработку кислотные отходы нейтрализуют (обезвреживают) с помощью реагентов, что позволяет снизить концентрацию отработанных соединений до допустимого уровня. Если в «отработке» содержатся твердые примеси, то их следует отделить. Отделение производят с помощью реакционного аппарата, который имеет мешалку и камерный фильтр-пресс. Осадок, полученный в ходе процесса отделения, обычно вывозят на полигоны опасных отходов или подвергают захоронению. Оставшуюся жидкость, в зависимости от состава отработанной кислоты, направляют на дальнейшую переработку либо уничтожают.
Отработанные синильная кислота, плавиковая кислота, пикриновая кислота также подвергаются утилизации в соответствии с особенностями происходящего процесса (для каждого вещества) по всем правилам техники безопасности. Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Об особенностях утилизации других распространенных кислотных отходов рассказано ниже.
Как очистить воду солью
Вместо соды можно применять соль. Считается, что практичней всего проводить автоматический солевой электролиз посредством специального прибора.
Устройство продается в интернете и обычных, специализированных магазинах.
Данное предложение заключается в использовании электрического тока безопасного уровня напряжения. Существует два вида соляных установок:
- Соляная установка заправляется химическими веществами, содержащими в своем составе хлор.
- Установка производящая дезинфицирующее средство прямо из соли.
Плюсы данной установки:
- Не надо вручную вводить дезинфицирующее средство.
- Использование только соли исключает попадание в воду вредных химических соединений;
- Соль растворяется непосредственно в воде, образуя газообразный хлор – мощный природный
- дезинфицирующий компонент;
- Дезинфицирование производится блоком управления, лишенным циануровой кислоты (стабилизатора), наполнителей, химических связующих веществ, присутствующих в классических хлорных дезинфекторах;
- Плотность соли в воде соответствует плотности данного химического элемента в селезенке человека;
- Нет необходимости в хлоросодержащих и кислотосодержащих реагентах, что уменьшает расходы по эксплуатации и упрощает процесс ухода за бассейном;
- В ячейке электролиза происходит дополнительная дезинфекция;
- Соленая вода – природный, экологически безопасный антисептик, предотвращающий образование и размножение водорослей;
- Передозировка невозможна;
- Не требуется дополнительных резервуаров;
- Оборудование компактно и легко подключается к энергосети;
- Установка автоматизирована.
Рекомендовано для Вас:
Как очистить самогон содой в домашних условиях
Советы:
- Если бассейн домашний и им пользуется не много людей, хлор в воду, продезинфицированную солевым раствором, не добавлять.
- В спортивных комплексах без гранулированного хлора обойтись нельзя;
- В случае оседания соли на дно и стенки бассейна, чистку начинают с использования специальных средств растворяющих соль;
Обработка в домашних условиях
Чтобы очистить металл от ржавчины, не нужно использовать промышленное оборудование. Можно провести работы в домашних условиях. Для этого нужно подготовить инструменты, расходные материалы. Нельзя забывать про соблюдение правил техники безопасности.
Инструменты
Для обработки металла ортофосфорной кислотой нужно подготовить:
- глубокую емкость из нержавеющей стали;
- валик, широкую кисть или распылитель (если нет подходящей посуды для полного погружения металлической детали);
- реактив;
- нашатырный и медицинский спирт, воду;
- пластиковую палочку;
- моющее средство.
Дополнительно может понадобиться щетка по металлу.
Щетку по металлу (Фото: Instagram / hoz.magazin)
Приготовление раствора
Перед началом обработки металлической детали нужно приготовить рабочий раствор:
- В металлическую емкость налить 1 литр воды.
- Добавить 150 мл кислоты.
- Перемешать компоненты пластиковой палочкой.
Также нужно сделать состав для смывки остатков едкого вещества. Способ приготовления:
- Налить в стеклянную банку 500 мл воды.
- Добавить 50 мл медицинского спирта, 450 мл нашатыря.
- Перемешать компоненты.
После подготовки кислотного раствора можно приступать к обработке.
Обработка
Очистка металла от ржавчины:
- Подготовить рабочую поверхность. Счистить грубые загрязнения щеткой по металлу.
- Полиэтиленовой пленкой заклеить части детали, которые не нужно обрабатывать. Так их можно защитить от едкого воздействия реактива.
- Обезжирить рабочую поверхность от жировой пленки моющим составом. Убрать остатки влаги сухой тряпкой.
- Покрыть подготовленную часть заготовки очищающим составом валиком, кистью или распылителем. Оставить на 1 час.
Останется смыть остатки ржавчины, грязи, кислоты с помощью моющего раствора
Важно помнить, что химическим реактивом невозможно счистить толстый слой ржавчины. Для этого нужно использовать болгарку со шлифовальным диском или гриндер
Результаты обработки (Фото: Instagram / sk.elvis)
Техника безопасности
Правила техники безопасности:
- Проводить работы нужно в защитной экипировке. Необходимо надевать респиратор, резиновые перчатки, одежду с длинными рукавами, защитные очки.
- Помещение должно хорошо проветриваться.
- С рабочего стола следует убрать воспламеняющиеся вещества, нагревательное оборудование, источники открытого пламени.
- После работы с некоторыми порошковыми реактивами нужно почистить зубы, прополоскать полость рта.
- После использования химических веществ необходимо тщательно вымыть руки.
Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств.
Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью
специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома.
Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса — особо не опасна, к тому же, средств для её получения нужно немного.
Итак, для опыта нам необходим источник
тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу)
будем брать графитовый, — чтобы не растворялся. Катод – лучше взять виде графитовой пластинки,
но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение
бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически
вынимать катод » — » и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт,
тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если
опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак
серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства.
Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё
полученной кислотой, — при этом должно наблюдаться бурное выделение газа – это углекислый газ.
Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и
пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с
ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса
или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к.
пары кислоты очень опасны.
- HCl — pH=1,0
- CCl3COOH — pH=1,2
- H2C2O2 — pH=1,3
- NaHSO4 — pH=1,4
- Винная кислота — pH=2,0
- Лимонная кислота — pH=2,1
- Молочная кислота — pH=2,4
- Салициловая кислота — pH=2,4
- Янтарная кислота — pH=2,7
- C6H5COOH — pH=2,8
- CH3COOH — pH=2,9
- NH4H2PO4 — pH=4,0
- H2S — pH=4,1
- NaH2PO4 — pH=4,5
- KH2PO4 — pH=4,7
- HCN — pH=5,1
- NH4Cl — pH=5,1
- H3BO3 — pH=5,3
- (NH4)2SO4 — pH=5,5
- Фенол — pH=5,5
- CaCO3 — pH=7,3
- (NH4)2HPO4 — pH=7,9
- C6H5COONa — pH=8,0
- NaHCO3 — pH=8,3
- CH3COONa — pH=8,9
- Na2HPO4 — pH=9,2
- Mg(OH)2 — pH=10,0
- KCN — pH=11,1
- NH3 — pH=11,3
- Na2CO3 — pH=11,6
- Na3PO4 — pH=12,0
- Ca(OH)2 — pH=12,4
- Na2SiO3 — pH=12,6
- K2S — pH=12,8
- NaOH — pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос «какая же из кислот более кислая ?!» «или какая из щелочей более едкая ?!»
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота «кислее» и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока… понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Утилизация реактивов
Первая группа более обширна, она включает:
неорганические соединения;
отходы органики;
радиоактивные продукты (см. также ).
Это может показаться удивительным, но утилизация химических реактивов затрагивает также отработанные вещества с атомных электростанций. Более того их утилизация наиболее затратная, поскольку требует установки сложного дорогостоящего оборудования. Впрочем, остатки веществ любой из перечисленных категорий, несут в себе сразу несколько видов опасности. Они могут быть токсичными, легко-воспламеняемы и взрывоопасны.
Вторая проблема, связанная с утилизацией реактивов, – их высокая востребованность. Действительно, эту группу составляют любые вещества, обладающие способностью вступать в реакции с другими соединениями, ежедневно использующиеся не только в промышленности, но и в хозяйственной деятельности предприятий и даже на бытовом уровне. Именно большие объемы остатков химреактивов и создают серьезные проблемы для их утилизации. Условно, реактивы можно разделить на основания – щелочи и кислоты. При этом последние достаточно опасно просто хранить в земле, поскольку повышение кислотности почв пагубно воздействует на большинство представителей флоры и фауны.
Один из способов переработки органических отходов
Витриоло, история серной кислоты
В средневековой Европе серная кислота была известна алхимикам как купорос, масло купороса или ликер купороса. Он считался наиболее важным химическим веществом и пытался использовать в качестве философского камня.
У шумеров уже был список нескольких видов купороса. Кроме того, Гален, греческий доктор Диоскорид и Плиний Старший, подняли вопрос о медицинском применении..

В эллинистических алхимических работах уже упоминалось металлургическое использование веществ из стекловидного тела. Витриол — это группа стеклообразных минералов, из которых можно получить серную кислоту..
Серная кислота и автопротолиз
Чистая H2SO4 или безводная H2SO4 является очень полярной жидкостью, что означает, что она содержит молекулы, в которых полярные связи – связи между двумя атомами, которые распределены неравномерно – имеют очень слегка отрицательный и положительный заряд на противоположных концах. Эти заряженные концы могут притягивать или отталкивать противоположно заряженные почти соприкасающиеся молекулы посредством очень слабых диполь-дипольные силы, Серная кислота полностью ионизируется в присутствии воды на ионы гидрония (H30 +) и ионы сероводорода (HSO4–). Однако, без воды серная кислота ионизирует сама с собойгде две молекулы серной кислоты автопротолизуются с образованием одного протонированного иона серной кислоты H3SO4 + и одного иона сероводорода (HSO4–), как видно из уравнения ниже:
2 H2SO4 ⇌ H3SO4 + + HSO4-
Этот высокий уровень ионизации делает серную кислоту превосходной растворитель для широкого спектра реакций и хорошо превосходит свойства растворителя воды.
Определение
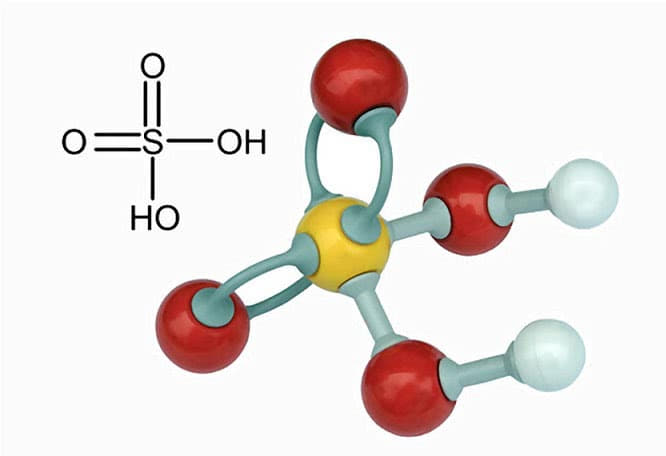
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.

Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу, почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности, Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Другие виды АКБ: можно ли приготовить электролит для них самостоятельно?

Отдельно хотелось бы обратить внимание на современные свинцово-кислотные источники питания — гелевые и AGM. Они также могут быть заправлены собственноручно приготовленным раствором, который в них находится в специфической форме — в виде геля или внутри сепараторов
Для заправки гелевых аккумуляторов понадобится ещё один химический компонент — силикагель, который загустит кислотный раствор.
Кадмиевоникелевые и железоникелевые аккумуляторы
В отличие от свинцовых источников питания, кадмиево- и железоникелевые заливаются щелочным растовром, который является смесью дистиллированной воды и едкого калия или натрия. Гидроксид лития, входящий в состав этого раствора для определённых температурных режимов, позволяет увеличить срок службы АКБ.

Таблица 2. Состав и плотность электролита для кадмиево- и железоникелевых и аккумуляторов.
Железоникелевые источники питания рекомендуется эксплуатировать в тех же условиях, что и кадмиево-никелевые. Однако стоит отметить, что они более восприимчивы к низким температурам. Поэтому их следует использовать до минус 20 градусов.
Зачем необходимо нейтрализовать
Полезное вещество добавляют в лекарства, краски, удобрения, взрывчатку – и это ещё не весь список. Но, соприкасаясь с H2SO4, человек может получить ожоги, случайно выпить её или облить на себя. Также необходимость нейтрализовать возникает после проведения опыта с использованием данного компонента. Способов это сделать несколько:
- С помощью металлов, таких как цинк, медь.
- Оксидами металлов.
- Щёлочь, гидроксид натрия и сода как наиболее яркий пример.
- Гидроксидом аммиака.
Если на кожу попала кислота, её промывают под проточной водой и нейтрализуют опасное вещество, прикладывая повязку, промоченную 2% раствором соды. Необходимость использования вышеперечисленных веществ возникает не только при экстренных ситуациях: H2SO4 быстро испаряется, так что в воздухе оказывается 300 мг на 1м2. А потому отработанный материал оставлять крайне опасно.
Как утилизировать щелочь на производстве
Утилизация щелочей производится в три этапа:
Транспортировка. Отработанные щелочи перевозятся в специально предназначенные для последующей утилизации места. При этом перевозка производится транспортом, который оснащен специализированным оборудованием. На такой транспорт помещают герметично закрытые баки с щелочными отходами. Герметичность необходима для того, чтобы не происходил контакт перевозимых отходов с другими соединениями. Эти баки устанавливаются в вертикальном положении и нумеруются.
Утилизация. Осуществляют реакцию нейтрализации, для этого используют кислоты. При реакции может происходить выделение достаточно большого количества теплоты в зависимости от выбранных реагентов
В связи с этим важно, чтобы процесс осуществлял специально обученный человек, соблюдая технику безопасности.
Переработка продуктов реакции. Образующиеся в результате реакции нейтрализации соли отправляются на дальнейшую переработку с целью последующего использования их в быту и производстве.

Тому, как осуществляется утилизация кислоты (в домашних условиях), использующейся в качестве электролита, посвящено следующее короткое видео:
Правильная утилизация кислот и щелочей – крайне важный процесс, позволяющий защищать природную среду и здоровье человека от негативного влияния агрессивных сред. Утилизировать такие опасные вещества можно самостоятельно, однако лучше все-таки пользоваться услугами профессионалов.
Развитие сернокислотной промышленности
Купорос процесс
Самым старым способом получения серной кислоты является так называемый «процесс купороса», основанный на термическом разложении купоросов, представляющих собой сульфаты различных типов природного происхождения..
Персидские алхимики Джабир ибн Хайян (также известный как Гебер, 721–815 гг. Н.э.), Рази (865–925 гг. Н.э.) и Джамал Дин аль-Ватват (1318 н.э.) включили в свои списки минералов классификацию купоросов.
Первое упоминание о «купоросном процессе» появляется в трудах Джабира ибн Хайяна. Затем алхимики Святой Альберт Великий и Василий Валентин описали процесс более подробно. В качестве сырья использовались квасцы и кальканит (синий купорос).
В конце средневековья серная кислота была получена в небольших количествах в стеклянных контейнерах, в которых сера сжигалась с помощью селитры во влажной среде..
Процесс купороса был использован в промышленном масштабе с шестнадцатого века из-за большего спроса на серную кислоту.
Витриоло де Нордхаузен
Основное внимание в производстве было уделено немецкому городу Нордхаузен (что стало называться купоросом как «купорос Нордхаузена»), где использовался сульфат железа (II) (зеленый купорос, FeSO).4 — 7H2O) в качестве сырья, которое нагревали, и полученный триоксид серы смешивали с водой, чтобы получить серную кислоту (купоросное масло). Процесс проводили в камбузах, некоторые из которых имели несколько уровней параллельно, чтобы получить большие количества купоросового масла
Процесс проводили в камбузах, некоторые из которых имели несколько уровней параллельно, чтобы получить большие количества купоросового масла.
Ведущие камеры
В 18 веке был разработан более экономичный процесс производства серной кислоты, известный как «процесс с использованием свинцовой камеры»..
До этого максимальная концентрация получаемой кислоты составляла 78%, в то время как с помощью «процесса купороса» были получены концентрированные кислота и олеум, поэтому этот метод продолжал использоваться в определенных секторах промышленности до появления «процесса контакт »в 1870 году, с помощью которого концентрированная кислота может быть получена дешевле.
Олеум или дымящая серная кислота (CAS: 8014-95-7) представляет собой раствор маслянистой консистенции и темно-коричневого цвета, переменного состава триоксида серы и серной кислоты, который можно описать формулой H2SW4.XSO3 (где х представляет собой свободное молярное содержание оксида серы (VI)). Значение для х 1 дает эмпирическую формулу H2S2О7, что соответствует дисульфуровой кислоте (или пиросерной кислоте).
процесс
Процесс свинцовой камеры был промышленным методом, используемым для производства серной кислоты в больших количествах, прежде чем его вытеснил «контактный процесс»..
В 1746 году в Бирмингеме, Англия, Джон Робак начал производить серную кислоту в свинцовых камерах, которые были прочнее и дешевле, чем стеклянные контейнеры, которые использовались ранее, и их можно было сделать намного больше..
Диоксид серы (от сжигания элементарной серы или металлических минералов, содержащих серу, таких как пирит), вводился с паром и оксидом азота в большие камеры, облицованные свинцовыми листами..
Диоксид серы и диоксид азота растворяются, и в течение примерно 30 минут диоксид серы окисляется до серной кислоты..
Это позволило эффективно индустриализировать производство серной кислоты, и с различными усовершенствованиями этот процесс оставался стандартным методом производства в течение почти двух столетий..
В 1793 году Clemente y Desormes добился лучших результатов, введя дополнительный воздух в процесс камеры свинца.
В 1827 году Гей-Люссак представил метод поглощения оксидов азота из отходящих газов из свинцовой камеры..
В 1859 году Гловер разработал метод восстановления оксидов азота из вновь образовавшейся кислоты путем увлечения горячими газами, что позволило непрерывно катализировать процесс с помощью оксида азота..
В 1923 году Петерсен представил усовершенствованный процесс башни, который позволял ее конкурентоспособность по отношению к процедуре контакта до 1950-х годов.
Камерный процесс стал настолько устойчивым, что в 1946 году он все еще представлял 25% мирового производства серной кислоты.
Спрос на позолоченные изделия. Срок службы украшений с позолотой
Изделия из чистого золота имеют высокую стоимость, — поэтому доступны не для всех желающих. Прекрасной альтернативой являются презентабельные, качественные украшения из серебра с позолотой. Если не приглядываться, то такие украшения вполне могут быть приняты за золотые. К тому же они изготовлены из серебра, которое также является благородным и драгоценным металлом.
Позолоченные изделия имеют свой срок, который связан с износом слоя позолоты. Его также называют сусальным слоем. Специфика долговечности зависит от состава и толщины нанесения. Самыми долговечными являются украшения, на которые напылен слой жидкого сплава из золота и меди. Но если заменить медь на более дешевое олово, то срок службы покрытия будет меньше.
 Кольцо с позолотой
Кольцо с позолотой