Средства защиты
- Защита органов дыхания с помощью респираторов. Респираторы следует использовать только в следующих ситуациях: Респираторы должны использоваться как последнее средство защиты (то есть после принятия всех инженерно-технических и административных мер для контроля за ситуацией). В случае превышения допустимого уровня воздействия или при возникновении риска такого превышения. В соответствии с действующими правилами. Существует риск вредного воздействия по причине загрязнения атмосферы. В качестве СИЗ в случае ликвидации химического разлива. Сотрудники лаборатории, использующие респираторные маски, должны быть обучены правилам обращения с средствами индивидуальной защиты.
- Защита глаз с помощью защитных очков. При высоких концентрациях кислоты использование очков обязательно.
- Защита кожи и тела. Сотрудники лаборатории, работающие с химическими веществами, должны носить брюки в полный рост или их аналог, закрытую со всех сторон обувь и лабораторный халат.
- Соблюдение санитарно-гигиенических мероприятий: после работы с материалом тщательно вымойте руки.
Опасность обезвоживания
Нарушение водного баланса в результате диареи и рвоты может быть чревато необратимыми изменениями. Клетки организма состоят на 75−80 % из воды, поэтому все важные процессы протекают в водной среде. Недостаток жидкой составляющей часто становится причиной тяжелых нарушений функций систем и органов.
Исследователи Ющук и Бродов отмечают, что при дегидратации «происходит потеря не только воды, но и электролитов Na+, K+, Cl-» (Ющук Н. Д., Бродов Л. Е., 2001, с. 679). Это связано с тем, что вместе с жидкостью из организма выводятся минеральные соли. Наступает нарушение водно-электролитного баланса, следствием которого могут быть заторможенность и спутанность сознания, шок, угрожающие жизни брадикардии или редкое сердцебиение.
На менее тяжелых стадиях обезвоживания последствия тоже не столь безобидны. Наиболее распространенными из них являются:
- замедление обмена веществ;
- кислородное голодание, в том числе мозга;
- утяжеление интоксикации;
- нарушение терморегуляции, перегрев организма и др.
Особенно чувствительны к нехватке воды клетки мозга, поскольку их нормальная работа возможна при уровне влаги не менее 90 %.
Степени обезвоживания
Обезвоживание при диарее развивается последовательно. Скорость прогрессирования состояния зависит от тяжести интоксикации, частоты стула, эпизодов рвоты, возраста и исходного состояния здоровья человека. Существует четыре степени обезвоживания, каждую из которых легко распознать по характерным симптомам.
Стоит отметить, что в самом начале типичных проявлений может не быть. Осадчук и Урюпин указывают на то, что раннее обезвоживание «не имеет признаков или симптомов» (Осадчук М. А., Урюпин А. А., Осадчук М. М., Бурдина В. О., 2014, с. 1112)
Но важно учесть, что жажда возникает еще до начала водного дисбаланса, поэтому этот симптом может присутствовать.
Первая степень
Легкая степень обезвоживания наблюдается в большинстве случаев диареи у взрослых и не представляет серьезной угрозы. При эпизодах жидкого стула каждые пять часов и отсутствии рвоты этой степенью может ограничиться
Важно знать, что первая степень дегидратации характеризуется потерей 3 % массы тела.
Вторая степень
Для второй степени обезвоживания организма при диарее симптомы более типичны:
- сильная жажда;
- повышение вязкости слюны;
- снижение эластичности кожи;
- раздражительность, беспокойство;
- темная моча;
- слабость;
- сонливость.
Глазные яблоки становятся менее увлажненными, возможно их западание. Потеря массы тела достигает 4−6 %. Вторая степень требует быстрой коррекции.
Третья степень
Жидкий стул более шести раз в сутки приводит к потере до 9 % массы тела. Состояние сопровождается следующими симптомами обезвоживания при поносе:
- бледность и прохладность кожных покровов;
- головная боль;
- головокружение;
- редкое мочеиспускание;
- тахикардия, одышка;
- судороги.
При острых кишечных инфекциях (бактериальных и вирусных) повышается температура тела. При этом механизмы терморегуляции нарушаются из-за отсутствия нужного объема воды. Это может быть опасно, поэтому требуются срочные меры по восполнению жидкости.
Четвертая степень
Развивается на фоне десяти и более эпизодов жидкого стула и рвоты в сутки. Симптомы утяжеляются, а потеря массы тела достигает 10 % и более
Важно понимать, что при потере 25 % наступает смерть взрослого человека, поэтому терапия в этом случае требуется безотлагательно.
К проявлениям обезвоживания добавляются серьезные симптомы и последствия:
- шок;
- спутанность сознания;
- полное отсутствие выделения мочи (мочеиспускания нет восемь часов и более);
- холодные, влажные на ощупь конечности;
- слабый пульс;
- критически низкое артериальное давление.
Черты лица человека могут заостряться, появляется учащенное дыхание, развивается нарушение зрительного и слухового восприятия и др. В этом случае вызов скорой помощи — жизненная необходимость.
характеристики
| Массовая доля w в% | Массовая концентрация β в г / л | Мольная концентрация c в моль / л | Плотность ϱ в г / см³ |
|---|---|---|---|
| 10,5 | 110 | 3,06 | 1.050 |
| 15.5 | 166 | 4,61 | 1.075 |
| 20,4 | 224 | 6,22 | 1,100 |
| 22,3 | 248 | 6,89 | 1,110 |
| 24,3 | 272 | 7,56 | 1.120 |
| 26,2 | 296 | 8,22 | 1.130 |
| 28,2 | 321 | 8,92 | 1,140 |
| 30,1 | 347 | 9,64 | 1.150 |
| 32,1 | 372 | 10,23 | 1,160 |
| 34,2 | 400 | 11.11 | 1,170 |
| 36,2 | 428 | 11,89 | 1.180 |
| 38,3 | 456 | 12,67 | 1.190 |
| 40,4 | 485 | 13,47 | 1,200 |
Газообразный хлористый водород очень хорошо растворяется в воде : при 0 ° C 1 литр воды, если он все еще находится в жидкой фазе , растворяет 815 г или 507 литров газа с выделением тепла. При 20 ° C один литр насыщенной соляной кислоты содержит 720 г HCl. Зависимость плотности от концентрации показана в таблице справа, причем между ней и процентным содержанием хлористого водорода существует простая арифметическая зависимость: удвоенные десятичные знаки примерно соответствуют концентрации, например Б. соляная кислота плотностью 1,10 г · см -3 и содержанием HCl 20 процентов.
ρ{\ displaystyle \ rho}
- %знак равно200⋅(ρ-1){\ Displaystyle \% = 200 \ cdot (\ rho -1)}
Плавления и кипения поведение соляной кислоты в значительной степени зависит от его состава. В твердой фазе образуются четыре стехиометрических гидрата с определенными температурами плавления. Это моногидрат HCl · H 2 O с температурой плавления -15 ° C, дигидрат HCl · 2H 2 O с температурой плавления -18 ° C, тригидрат HCl · 3H 2 O с температурой плавления -25. ° C и гексагидрата HCl 6H 2 O с температурой плавления -70 ° C. На фазовой диаграмме показаны соответствующие эвтектические расплавы для составов между стехиометрическими гидратами . Это для смеси моно- и дигидрата с массовой долей хлористого водорода 57,3% при -23 ° C, для дигидрата и тригидрата с массовой долей 44,0% при -28 ° C, для три- и гексагидрата с массовая доля 26,6% при -73 ° C и гексагидрата и льда с массовой долей 23,0% при -75 ° C. Кроме того, между тригидратом и льдом образуется метастабильная эвтектика с массовой долей 24,8% при -87 ° C. В диапазоне концентраций от 0 до 25% наблюдается резкое падение температуры плавления. Фазовая диаграмма пар-жидкость между хлористым водородом и водой показывает . Полученная азеотропная точка кипения максимальна при нормальном давлении с массовой долей 20,2% при 109 ° C. При выпаривании растворов соляной кислоты с концентрацией, отличной от азеотропного состава, избыток компонента сначала предпочтительно выпаривают, т.е. Другими словами, в случае соляной кислоты с массовой долей <20,2% происходит концентрирование, в случае соляной кислоты с> 20,2% концентрация снижается до тех пор, пока не будет достигнута композиция азеотропа с постоянным кипением. Кривая кипения на фазовой диаграмме над азеотропным составом коррелирует с кривой растворимости хлористого водорода в воде. При 25 ° C массовая доля 42% соответствует «дымящей» соляной кислоте.
Хлороводород полностью диссоциирует в воде , соляная кислота с 32% имеет значение pH -1. Во влажном воздухе газообразный хлористый водород образует туман из мелких капель соляной кислоты. Разбавленная соляная кислота — хороший проводник электричества .
Физико-химические свойства и состав
Перед тем, как сделать паяльную кислоту, следует ознакомиться с составом материала. В данное вещество входят:
- Кислота соляная;
- Хлорид амония;
- Хлорид цинка;
- Вода деионизированная;
- Смачивающая присадка.
Паяльная кислота в домашних условиях может иметь другие компоненты в своем составе. Главное, чтобы добиться обязательных свойств, которыми обладает этот флюс. Во-первых, здесь должна присутствовать высокая активность материала. Быстрое взаимодействие с элементами придает среде агрессивность и уничтожение практически всех вредных веществ, которые мешают нормальному проведению пайки. Это имеет побочный эффект, так как мелкие детали из металла могут пострадать в результате соприкосновения с кислотой. Подобными свойствами обладает и жир паяльный активный.
Как добывают соляную кислоту в лабораторных условиях

Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
- Водород сжигается в хлоре (синтетический).
- Попутный (абгазный). Суть его в проведении органического хлорирования, дегидрохлорирования.
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Правила домашней регидратации
Прием раствора от обезвоживания при рвоте и поносе возможен только при удовлетворительном состоянии и отсутствии опасений за здоровье
Важно учесть степень дегидратации, поскольку с легкой степенью возможно справиться самостоятельно. Следует придерживаться следующих правил:
пить нужно часто и небольшими порциями, особенно в случаях с частой рвотой — важно не раздражать и не растягивать желудок;
в качестве напитка лучше выбирать чистую воду, допускается употребление некрепкого чая, несладких морсов, минеральной воды без газа;
нужно отслеживать эффективность проводимых мер — следить за частотой мочеиспускания, общим состоянием, а при отсутствии результата спустя несколько часов незамедлительно обратиться к врачу.
Врачи Осадчук и Урюпин в своей работе указывают, что «при нетяжелой диарее регидратация может проводиться в домашних условиях с помощью раствора оральных регидратационных солей, который представляет собой смесь чистой воды, соли и сахара. Указанный раствор впитывается в тонком кишечнике и замещает воду и электролиты, выведенные из организма с фекалиями» (Осадчук М. А., Урюпин А. А., Осадчук М. М., Бурдина В. О., 2014, с. 1112)
Также исследователи заостряют внимание на том, что продолжительность диареи уменьшают добавки цинка.
В качестве раствора можно приобрести готовое аптечное средство или приготовить его самостоятельно: для этого достаточно растворить в литре чистой воды половину чайной ложки соли и две столовые ложки сахара.
Когда удастся унять рвоту и улучшить состояние, к раствору можно добавить жидкости в виде бульонов — овощных, на диетической птице. Также может быть рекомендован рисовый отвар.
Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств.
Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью
специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома.
Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса — особо не опасна, к тому же, средств для её получения нужно немного.
Итак, для опыта нам необходим источник
тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу)
будем брать графитовый, — чтобы не растворялся. Катод – лучше взять виде графитовой пластинки,
но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение
бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически
вынимать катод » — » и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт,
тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если
опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак
серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства.
Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё
полученной кислотой, — при этом должно наблюдаться бурное выделение газа – это углекислый газ.
Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и
пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с
ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса
или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к.
пары кислоты очень опасны.
- HCl — pH=1,0
- CCl3COOH — pH=1,2
- H2C2O2 — pH=1,3
- NaHSO4 — pH=1,4
- Винная кислота — pH=2,0
- Лимонная кислота — pH=2,1
- Молочная кислота — pH=2,4
- Салициловая кислота — pH=2,4
- Янтарная кислота — pH=2,7
- C6H5COOH — pH=2,8
- CH3COOH — pH=2,9
- NH4H2PO4 — pH=4,0
- H2S — pH=4,1
- NaH2PO4 — pH=4,5
- KH2PO4 — pH=4,7
- HCN — pH=5,1
- NH4Cl — pH=5,1
- H3BO3 — pH=5,3
- (NH4)2SO4 — pH=5,5
- Фенол — pH=5,5
- CaCO3 — pH=7,3
- (NH4)2HPO4 — pH=7,9
- C6H5COONa — pH=8,0
- NaHCO3 — pH=8,3
- CH3COONa — pH=8,9
- Na2HPO4 — pH=9,2
- Mg(OH)2 — pH=10,0
- KCN — pH=11,1
- NH3 — pH=11,3
- Na2CO3 — pH=11,6
- Na3PO4 — pH=12,0
- Ca(OH)2 — pH=12,4
- Na2SiO3 — pH=12,6
- K2S — pH=12,8
- NaOH — pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос «какая же из кислот более кислая ?!» «или какая из щелочей более едкая ?!»
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота «кислее» и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока… понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Первая помощь при химических ожогах
Все мероприятия по оказанию помощи людям с химическими ожогами сводятся к скорейшей доставке пострадавших в больницу. Тем не менее есть несколько правил оказания первой помощи при контакте с соляной кислотой:
- Если человек все еще находится в зоне с повышенной концентрацией хлористого водорода, его нужно скорее вывести из опасной зоны. По возможности надеть на пострадавшего противогаз.
- Промыть пораженные участки кожи и глаза большим количеством воды.
- После эвакуации в безопасное место рекомендован покой и согревание пострадавшего.
- Если у человека наблюдается затрудненное дыхание, можно приложить теплый компресс на область шеи и доставить пострадавшего в медицинское учреждение.
Как приготовить 1-процентный солевой раствор?
- Для изготовления 1 % раствора соли нужно взять на 100 г воды 1 г соли (если придерживаться максимально точных расчетов, то тогда понадобится воды 99 г, но обычно такой ничтожной разницей пренебрегают).
- Если в доме нет чувствительных весов или специальных емкостей с отметками для измерения малых величин, то в таком случае соль проще всего отмерить чайной ложкой.
- В 1 ч.л. «без горки» поместится около 7 г соли, а если зачерпнуть ее с «горкой», то 10. Поэтому для 1% состава нужно воспользоваться именно вторым вариантом, т.е. — с «горкой».
- Но помните: если вы отмеряете именно такую дозу соли, то ее нужно будет растворить в литре воды. С водой еще проще: ее можно отмерить 100 г рюмкой (если вы будете растворять в ней именно 1 г соли).
- Если для этой цели пользоваться стандартным стаканом, то следует помнить, что в нем помещается 250 мл (или г) чистой воды. Но проще всего для измерения количественного состава воды воспользоваться литровой банкой – наверняка в каждом доме найдутся такие емкости, используемые хозяйками под закрутки.
Точно так же, используя чайную ложку, можно приблизительно высчитать, сколько соли надо размешать в воде, чтобы получился раствор со всеми иными процентными соотношениями.

Важна правильная концентрация соли
Как и для чего применяют
Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
- Металлургия. Очистка поверхностей от окисленных участков, растворение ржавчины, обработка перед спайкой, лужением. Соляная кислотапомогает извлекать мелкие вкрапления металлов из руд. Цирконий и титан получают, используя способ переведения оксидов в хлориды.
- Промышленность пищевых технологий. Раствор с низкой концентрацией применяется в качестве пищевой добавки. Желатин, фруктоза для диабетиков содержат в своем составе чистый эмульгатор. Обычная сода так же обладает высоким коэффициентом содержания данного вещества. На упаковке товаров увидите его под названием Е507.
- Область медицины. При недостаточном показателе кислотной среды в желудке и проблемах с кишечником. Низкий уровень Ph приводит к появлению рака. Даже при надлежащем питании, витаминов в достатке, опасность не исчезает, необходимо проводить анализы для получения сока из желудочного тракта, ведь при недостаточно кислой среде полезные вещества практически не всасываются, нарушается пищеварение.
- Раствор соли используется как ингибитор – защита от грязи и инфекций, антисептическое действие. Для изготовления клеевых смесей, изделий из керамики. Ним промывают теплообменники.
- Процедура очистки воды для питья тоже не обходится без участия хлора.
- Изготовление каучука, отбеливание тканевых основ.
- Можно ухаживать за линзами с помощью данного раствора.
- Полоскание полости рта в домашних условиях
- Вещество отлично проводит электрический ток.
Работа с соляной кислотой – MSDS Совет
Соляная кислота является опасной жидкостью и имеет свои паспорт безопасности материала (Паспорт безопасности). Это информация, в которой перечислены факторы безопасности и гигиены труда, связанные с ее использованием, и она должна быть доступной и легко доступной для обнаружения потенциально опасных материалов.
Соляная кислота едкая; концентрированные формы также выделяют токсичный кислотный туман. Если кислота или туман попали на кожу, глаза или внутренних органов, любое повреждение может быть необратимым или, возможно, смертельным исходом. Хотя HCl не классифицируется как канцероген, его промышленное использование требует средств индивидуальной защиты такие как респиратор, резиновые перчатки и ботинки, а также защитная маска. Кроме того, любые помещения, в которых используется соляная кислота, должны иметь доступ к системе для промывки глаз. Даже при уборке в домашних условиях разбавленными средствами брызги на глаза или кожу могут вызвать ожоги.
Рекомендации MSDS для контакта соляной кислоты с кожей состоят в том, чтобы промыть область в течение не менее 15 минут и удалить все предметы одежды, которые попали в раствор. Там, где видны ожоги, рекомендуется мытье антибактериальным мылом или антибактериальным кремом, а также посещение медицинского центра. При контакте с глазами необходима промывочная система, которая промывает пораженный глаз не менее 15 минут и требует медицинской помощи.
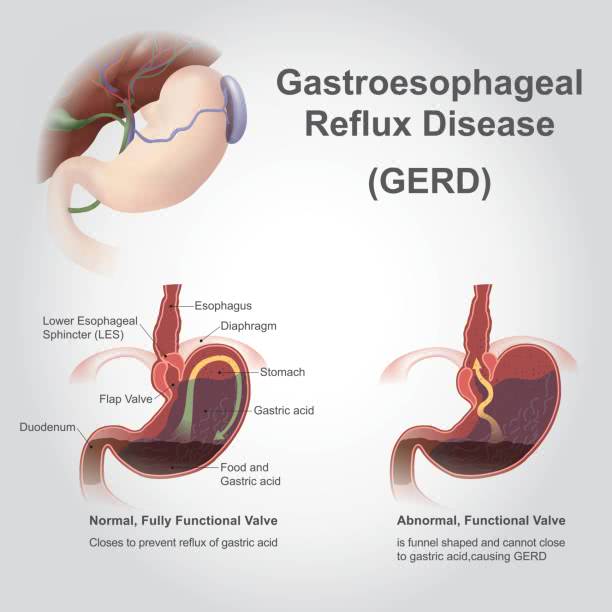
Прием внутрь соляной кислоты любой концентрации может вызвать ожоги полости рта, горла и пищевод, Хотя желудочный сок очень кислый, он остается в резервуаре желудка. Расстройство желудка, вызванное ростом желудочной кислоты в нижнюю часть пищевода, может вызвать эзофагит Барретта и увеличить риск развития рака пищевода
Распространенным расстройством желудочно-кишечного тракта является гастроэзофагеальная рефлюксная болезнь или ГЭРБ, Изображение ниже показывает признаки и симптомы этого часто болезненного патология, При проглатывании HCl важно не рвать, а немедленно обратиться за медицинской помощью. Вдыхание тумана HCl также требует посещения отделения неотложной помощи
Централизованная утилизация

Если количество кислот, которые требуется утилизировать, измеряется
литрами или десятками литров, требуется заказывать услуги специальных компаний.
Процедура выглядит следующим образом:
- Специалист компании проведет инвентаризацию, оценку, сортировку и упаковку с истекшим сроком годности, химических веществ и материалов, которые больше не потребуются;
- Найденные объекты сортируются по принципу совместимости, а затем упаковываются в соответствующий контейнер (обычно бочки по 200 л) с соответствующим абсорбентом;
- Контейнеры, готовые к отправке, должны соответствовать всем нормативным требованиям, включая маркировку, обозначение отходов и наличие необходимых транспортных документов;
- Исходя из предпочтений заказчика, отходы вывозятся в тот же день или по расписанию.
- Отходы вывозятся и перевозятся в пункт назначения до ближайшего разрешенного полигона захоронения или перерабатывающего производства.
Для пользователей сайта Vyvoz.org нами был собран (и постоянно пополняется) перечень организаций в крупных (и не только) городах России, которые занимаются утилизацией кислот:
МоскваСанкт-ПетербургАстраханьБарнаулВладивостокВолгоградВоронежЕкатеринбургИжевскИркутск
КазаньКалининградКемеровоКировКраснодарКрасноярскЛипецкМахачкалаНабережные ЧелныНижний Новгород
НовокузнецкНовосибирскОмскОренбургПензаПермьРостов-на-ДонуРязаньСамараСаратов
ТольяттиТомскТулаТюменьУльяновскУфаХабаровскЧебоксарыЧелябинскЯрославль
На предприятии или учреждении должна сохраняться соответствующая документация: журналы учета опасных отходов, приказ о назначении ответственного лица, договор на утилизацию, акты приема-передачи и утилизации, переработки кислот. При отсутствии этих документов представители контролирующих органов составят акт о нарушении и наложат штраф. Юридическим лицам придется уплатить до 250 т.р. и более.
https://youtube.com/watch?v=Nz_yDgRVkuQ
Утилизация кислот в домашних условиях.
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl
в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl
. В молекуле атомы водорода соединяются с атомами галогена – Cl
. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s
-орбитали водорода и обе 3s
и 3p
-орбитали атома Cl
. В химической формуле Соляной Кислоты 1s-
, 3s-
и 3р
-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s
-орбиталь не носит связывающий характер. Наблюдается смещение электронной плотности к атому Cl
и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами
).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль. При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³. В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН
, сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей. Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты
разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H
. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота
слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. и карбонат натрия
будут образовывать после реакции с HCl
хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца
, перманганатом калия
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Вещество реагирует с аммиаком
, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца
: MnO2+4HCl=Cl2+MnO2+2H2O
(реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра
выпадает белый осадок хлорида серебра
и образуется азотная к-та
. Уравнение реакции взаимодействия метиламина
с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl
.
Вещество реагирует со слабым основанием анилином
. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин
(хлорид фениламмония
): (С6Н5NH3)Cl
. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3
. Уравнение реакции карбоната калия
с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Делаем паяльную кислоту
Все люди, которые паяют и паяли когда-либо металлические изделия, знают, как сложно припаять к металлу олово. Конечно же, такую кислоту всегда можно купить в магазине, но всегда проще что-то сделать своими руками и понять процесс изготовления определенных вещей, чем покупать уже готовые продукты в магазине.
Если вы хотите попробовать сделать паяльную кислоту у себя дома, то смотрите видео
https://youtube.com/watch?v=OVQaK32aU1Y
Для изготовления паяльной кислоты, нам понадобится: — соляная кислота, концентрированная;— цинк в гранулах или стаканчики от старых батареек;— баночка.
Если вы не нашли цинк в гранулах, вы можете использовать бочонки от старых батареек или обратится в пункт скупки цветного металла, там очень часто бывает цинк, который вы сможете приобрести. Если у вас дома не оказалось неиспользованных батареек, а в пункте цветных металлов не оказалось лишнего цинка, то просто пройдитесь по рынку, там можно очень часто найти людей, которые продают цинк.
Паяльная кислота получается, когда в соляной кислоте растворяется цинк из расчета 412 грамм цинка на 1 литр соляной кислоты.
Насыпаем цинк и аккуратно заливаем все соляной кислотой, но ее уровень не должен превышать ¾ глубины посуды. Когда цинк полностью растворится, то прекратится полностью растворение пузырьков водорода.
Важно! При изготовлении паяльной кислоты всегда соблюдайте технику безопасности. Надевайте защитные перчатки, а защитные очки на глаза
Когда зальем цинк соляной кислотой, у нас будет огромное количество пузырьков и пара. Пар – это жидкий водород, а пузырьки – это происходит реакция, при которой полностью растворяется наш цинк.
Реакция будет достаточно продолжительная, но вам придется дождаться, пока растворится весь цинк.
Дождитесь того момента, когда поверхность соляной кислоты будет без газообразований. На низу остатки от цинка должны перестать выпускать газы и только тогда соляной кислотой можно начинать пользоваться.
Получайте на почту подборку новых самоделок. Никакого спама, только полезные идеи!
*Заполняя форму вы соглашаетесь на обработку персональных данных