Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств.
Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью
специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома.
Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса — особо не опасна, к тому же, средств для её получения нужно немного.
Итак, для опыта нам необходим источник
тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу)
будем брать графитовый, — чтобы не растворялся. Катод – лучше взять виде графитовой пластинки,
но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение
бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически
вынимать катод » — » и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт,
тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если
опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак
серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства.
Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё
полученной кислотой, — при этом должно наблюдаться бурное выделение газа – это углекислый газ.
Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и
пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с
ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса
или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к.
пары кислоты очень опасны.
- HCl — pH=1,0
- CCl3COOH — pH=1,2
- H2C2O2 — pH=1,3
- NaHSO4 — pH=1,4
- Винная кислота — pH=2,0
- Лимонная кислота — pH=2,1
- Молочная кислота — pH=2,4
- Салициловая кислота — pH=2,4
- Янтарная кислота — pH=2,7
- C6H5COOH — pH=2,8
- CH3COOH — pH=2,9
- NH4H2PO4 — pH=4,0
- H2S — pH=4,1
- NaH2PO4 — pH=4,5
- KH2PO4 — pH=4,7
- HCN — pH=5,1
- NH4Cl — pH=5,1
- H3BO3 — pH=5,3
- (NH4)2SO4 — pH=5,5
- Фенол — pH=5,5
- CaCO3 — pH=7,3
- (NH4)2HPO4 — pH=7,9
- C6H5COONa — pH=8,0
- NaHCO3 — pH=8,3
- CH3COONa — pH=8,9
- Na2HPO4 — pH=9,2
- Mg(OH)2 — pH=10,0
- KCN — pH=11,1
- NH3 — pH=11,3
- Na2CO3 — pH=11,6
- Na3PO4 — pH=12,0
- Ca(OH)2 — pH=12,4
- Na2SiO3 — pH=12,6
- K2S — pH=12,8
- NaOH — pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос «какая же из кислот более кислая ?!» «или какая из щелочей более едкая ?!»
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота «кислее» и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока… понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Производство
Соляную кислоту обычно получают промышленным способом путем растворения хлористого водорода в воде. Хлористый водород может быть получен разными способами, и, таким образом, существует несколько предшественников соляной кислоты. Крупномасштабное производство соляной кислоты почти всегда интегрируется с промышленным производством других химикатов , например, в хлорно-щелочном процессе, который производит гидроксид , водород и хлор, последний из которых может быть объединен для получения HCl.
Промышленный рынок
Соляная кислота выпускается в растворах с содержанием HCl до 38% (концентрированная)
Химически возможны более высокие концентрации до чуть более 40%, но при этом скорость испарения настолько высока, что при хранении и обращении требуются дополнительные меры предосторожности, такие как создание давления и охлаждение. Таким образом, массовая продукция промышленного класса составляет от 30% до 35%, что оптимизировано для обеспечения баланса между эффективностью транспортировки и потерями продукта из-за испарения
В Соединенных Штатах растворы от 20% до 32% продаются как соляная кислота. Растворы для бытовых целей в США, в основном для очистки, обычно составляют от 10% до 12%, при этом настоятельно рекомендуется разбавлять их перед использованием. В Соединенном Королевстве, где он продается как «Солевой спирт» для бытовой химии, его эффективность такая же, как у промышленного сорта США. В других странах, таких как Италия, соляная кислота для бытовой или промышленной очистки продается как «Acido Muriatico», и ее концентрация колеблется от 5% до 32%.
Основные мировые производители включают Dow Chemical с производительностью 2 млн метрических тонн в год (2 млн тонн в год) в пересчете на газ HCl, Georgia Gulf Corporation , Tosoh Corporation , Akzo Nobel и Tessenderlo с объемом производства от 0,5 до 1,5 млн тонн в год каждая. Общее мировое производство, в целях сравнения, выраженное в HCl, оценивается в 20 Мт / год, из которых 3 Мт / год — за счет прямого синтеза, а остальное — как вторичный продукт в результате органического и аналогичного синтезов. Безусловно, большая часть соляной кислоты потребляется производителем самостоятельно. Объем открытого мирового рынка оценивается в 5 млн т / год.
Устройство солевого бака
Все реагентные баки устроены примерно одинаково. Солевой бак устроен очень просто:
Солевой бак представляет собой емкость любой формы и размера, внутри которой находится фальшдно, на которое ложится соль.
Фальшдно перфорированное и сквозь него спокойно проникает вода. Это позволяет растворять всю соль полностью без остатка.
Стаканчики выполняют роль опоры и дополнительно помогают растворять остатки соли.
Механизм солевого бака находится в пластиковой шахте, отделяющей механизм от таблетированной соли.
Механизм представляет собой двухходовой кран, перекрывающий солепровод как при опускании уровня жидкости до нижней отметки (2 см над дном), так и перекрывает солепровод на подачу воды при подъеме поплавка (отсечка по верхнему уровню).
Солевые баки полностью выполнены из пластика, что делает их устойчивыми к агрессивному солевому раствору, благодаря чему солевые баки имеют очень большой срок службы — 10 и более лет.
Как правильно утилизировать кислоты
Важно! Известно, что кислоты являются ядовитыми. При неаккуратном обращении с ними, при попадании их на кожу или внутрь организма могут произойти ожоги, сильные отравления и даже летальный исход
Процесс, касающийся утилизации таких агрессивных сред на предприятиях, начинается с емкости, в которой эти вещества перевозятся и хранятся. Требования к таре при утилизации:
- Строго должны соблюдаться условия герметичности тары (она должна быть полностью герметичной), на нее должна быть нанесена специальная маркировка.
- Контейнер должен быть изготовлен из материала, инертного по отношению к перевозимым в нем веществам во избежание повреждения самого контейнера.
- Запрещается осуществлять смешивание разных кислот.
- Транспортировка тары с агрессивными отходами должна производиться специальным транспортом.
Поступившие на переработку кислотные отходы нейтрализуют (обезвреживают) с помощью реагентов, что позволяет снизить концентрацию отработанных соединений до допустимого уровня. Если в «отработке» содержатся твердые примеси, то их следует отделить. Отделение производят с помощью реакционного аппарата, который имеет мешалку и камерный фильтр-пресс. Осадок, полученный в ходе процесса отделения, обычно вывозят на полигоны опасных отходов или подвергают захоронению. Оставшуюся жидкость, в зависимости от состава отработанной кислоты, направляют на дальнейшую переработку либо уничтожают.
Отработанные синильная кислота, плавиковая кислота, пикриновая кислота также подвергаются утилизации в соответствии с особенностями происходящего процесса (для каждого вещества) по всем правилам техники безопасности. Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Об особенностях утилизации других распространенных кислотных отходов рассказано ниже.
https://youtube.com/watch?v=J4yMePjyw3o
Признаки пониженной кислотности
- кожа стала сухой, шелушащейся;
- на лице возникают прыщи;
- после еды появляется вздутие живота;
- изо рта пахнет «протухшими» яйцами.
Описанных симптомов в сочетании с опросом пациента достаточно, чтобы верно определить кислотность желудка.
Последствия пониженной кислотности
Аллергия
Из-за нехватки кислоты пища плохо переваривается и ее частицы попадают в кровоток. Организм реагирует на них как на отравляющие элементы и начинает интенсивно вырабатывать антитела.
Гельминтоз
Недостаток кислоты формирует идеальные условия для заселения кишечного тракта различными бактериями и червями.
Нарушения стула
Недостаток щелочной среды препятствует нормальному перевариванию продуктов, из-за чего непереваренные куски еды разлагаются внутри кишечника. Гниение стимулирует размножение патогенных бактерий, которые выделяют газы – появляется вздутие, развивается запор или диарея.
Депрессивные состояния
Здоровая нервная система – залог крепких нервов, хорошего настроения. Если между клетками плохо передаются нервные импульсы, у человека появляется апатичность, депрессивность, нарушаются когнитивные возможности: замедляются реакции, ухудшается память, снижается концентрация. Скорую передачу импульсов обеспечивают аминокислоты, которые формируются вследствие расщепления белков. Низкая кислотность желудочного сока не позволяет белкам проходить весь процесс расщепления.
Запоры и диарея
В «ощелаченном» организме пища долго переваривается, ее остатки разлагаются, провоцируя приступы метеоризма,
запоры и диарею.
Депрессии
От нехватки кислот белки не могут полноценно расщепляться
до аминокислот. Их недостаток приводит к нарушению передачи импульсов между нервными клетками, от чего развиваются апатия и депрессия, а также ухудшаются когнитивные функции мозга (реакция, память и пр.).
Что такое паяльная кислота и для чего она нужна
Если же вы учили химию, то знаете, что среди металлов есть вещества с большой активностью.
Многие из них вступают в реакцию с воздухом, в результате чего окисляются.
Оксиды, что образовались на поверхности металлов превращаются в гидроксиды из-за воздействия влаги, что находится в атмосфере.
Подобные смеси из продуктов окисления металла называют ржавчиной.
Ржавчина и другие оксидные слои, которыми покрываются другие металлы, не позволяют ничего припаять к заготовке.
Решить эту проблему помогает кислотные флюсы, кислотность которых бывает разная. Простейшие кислотные флюсы – паяльные кислоты.
Паяльной кислотой называют группу разнообразных составов на основе одного или нескольких химических элементов, которые можно изготовить самостоятельно.
Паста-депилятор: как приготовить дома
Чтобы изготовить пасту для шугаринга на домашней кухне с лимонной кислотой, потребуется подходящая посуда, плита и 3 ингредиента.
Посуда для приготовления
Карамель готовят в небольшой емкости из нержавеющей стали. Хорошо, если это будет кастрюля или ковш с утолщенным дном. Допустимо использовать эмалированную посуду, но нужно учитывать, что в этом случае есть риск повреждения покрытия.

Способы нагревания
Сварить пасту можно просто, поставив кастрюлю на плиту и включив минимальный режим. Но при таком методе велик риск пригорания сахара. Как поведет себя карамель будет зависеть от материала посуды и типа плиты. Индукционные, электрические, газовые конфорки по-разному, не всегда равномерно распределяют тепло.

Предпочтительнее воспользоваться водяной баней. Для этого берут 2 кастрюли, одна из которых немного меньше другой и достаточно свободно в нее входит. В большую емкость наливают небольшое количество воды и ставят на огонь, а меньшую кастрюлю, в которую помещают ингредиенты, ставят сверху. Дно верхнего яруса должно располагаться выше поверхности воды.
Между стенками кастрюлей на водяной бане не должно быть слишком большого зазора. Необходимо следить за тем, чтобы в смесь не попадали вода и прямые потоки пара.
Существует способ приготовления в микроволновке. Нельзя назвать его лучшим, поскольку микроволны меняют структуру продуктов, но можно быстрым. Приготовление занимает не более 5 минут.
Какой из способов и рецептов приготовления дома пасты для шугаринга с лимонной кислотой или соком лимона понравится больше, узнают лишь методом проб и ошибок. Изначально редко удается получить идеальную карамель. Если паста не удалась, то стоит попробовать новый способ приготовления или изменить параметры варки.
Изготовление реактора попытка №2
Проблему с расплавлением реактора я решил заменив пластмасс на дерево. Из куска ОСБ я вырезал кругляш просверлил в нём всё также 3 отверстия два под электроды и один под отвод газов. Дополнил конструкцию также ещё 2 болтами что бы проще было подключать и отключать как клеммы так и электроды, плюсом также было что они повышали герметичность конструкции. Также для удобства я заменил трубу на более короткую и нанёс на низ деревянной пробки силиконовый герметик. Герметик я использовал как прокладку для герметичности.
Болты для удобства подключения
Силиконовая прокладка
Более короткая пластиковая труба
Болты для удобства подключения
Теперь вроде не должен плавиться как я подумал в прицепе идея себя оправдала при испытании ни чего не расплавилось однако я упустил другой момент всё таки крышка прилегала не равномерно к банке и следовательно газ выходил из щелей так как не было достаточной герметичности. На скорую руку я постарался решить проблему обычными стяжками от части это помогло но это не решение проблемы.
Пришло время конструировать новый реактор не будем сдаваться и продолжим свои исследовательские опыты.
Что такое гиалуронрвая кислота?
Напомним, что гиалуроновая кислота — это полисахарид, который способен притягивать и удерживать молекулы воды в большом количестве, обеспечивая отличное увлажнение клеток. Она широко используется в косметологии при коррекции черт лица, в том числе и губ. Используется природная и синтезированная кислота.
Основное количество всей гиалуроновой кислоты сосредоточено в коже, располагается она в соединительной ткани дермы между волокнами коллагена и эластина, а также в клетках рогового слоя — корнеоцитах.Если провести некую аналогию и представить нашу кожу в виде матраса, то можно сказать, что коллаген и эластин — это пружины, а гиалуроновая кислота — это поролон, заполняющий пространство между ними.
Гиалуроновая кислота является естественной составляющей нашего организма. Она синтезируется в нем и участвует во многих биологических процессах. Ее роль в организме поистине неоценима
Самое важное и ценное качество — это способность связывать и удерживать воду. Известно, что одна молекула гиалуроновой кислоты связывает 500 молекул воды
Также она обладает так называемым «эффектом памперса» — способностью не отдавать влагу из кожи.
Будучи важным компонентом внеклеточного матрикса, гиалуронат обеспечивает жизнедеятельность клеток, заполняя пространство между ними. Гиалуроновая кислота обеспечивает транспортировку кислорода, лимфоцитов и других молекул крови и питательных веществ к месту повреждения тканей и очагов воспаления.
После 45 лет количество собственной гиалуроновой кислоты начинает уменьшаться. Поэтому многие прибегают к ее искусственному введению. Гиалуронопластика помогает запустить выработку собственной гиалуроновой кислоты, однако происходят и другие реакции.
Что образуется при взаимодействии
Кислотный остаток уже не так опасен, как исходный компонент. Интересно, что именно реакции с выделением углекислого газа сода обязана добавлением её в хлеб – углекислый газ, выделяющийся из-за взаимодействия с молочной кислотой, поднимает тесто и делает в нём пузырьки.
Примерно также происходит реакция нейтрализации: основание вступает в реакцию с H2SO4 и выделяется углекислый газ. Поэтому, чтобы этот химический опыт не превратился в плачевный жизненный, следует проводить его в проветриваемом помещении.
К вопросу о том, сколько соды необходимо для нейтрализации H2SO4. Если взять 1 часть кислоты, пригодится 1 часть щёлочи для реакции с ней, то есть соотношение будет 1:1. Но концентрированная кислота требует больше соды, здесь соотношение увеличится до 1:2. Раствор соды необходим 3%.
Кроме того, если необходимо оказать помощь при ожоге кислотой, то готовится раствор соды в очень приблизительном количестве: 1 чайная ложка щёлочи и на 2,5 стакана воды. Насколько эффективна реакция? В этом помогут разобраться отзывы тех, кто с ней часто сталкивается.
Рекомендовано для Вас:
Как применять и использовать кальцинированную соду в быту

https://youtube.com/watch?v=nHR4gO8iGKY


Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния. Во время реакции могут образоваться оксихлориды переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
- его используют в гидрометаллургии, при декапировании и травлении;
- при очистке металлов при лужении и пайке;
- в качестве реактива для получения хлорида марганца, цинка, железа и других металлов;
- при изготовлении смесей с ПАВ-ами для очистки металлических и керамических изделий от инфекции и грязи (применяется Кислота Соляная ингибированная);
- в качестве регулятора кислотности E507 в пищевой промышленности, в составе содовой воды;
- в медицине при недостаточной кислотности желудочного сока.
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Особенности утилизации соляной кислоты
Так называемая «солянка» часто используется в промышленности. В связи с этим возникают вопросы, как утилизировать соляную кислоту, как осуществляется процесс.
Утилизация соляной кислоты имеет некоторые трудности, связанные непосредственно с процессом. Она должна производиться по следующим правилам:
- Нейтрализация. Применяют растворы щелочей, например, 5% раствор гидроксида кальция и т.д. Следует учесть, что пролившуюся «солянку» можно нейтрализовать с помощью воды, которую подают посредством поливочных или пожарных машин. Грунт с попавшей на него «солянкой» срезается и отвозится затем на специальный полигон.
- Утилизация раствора хлороводорода в промышленных объемах. Просто нейтрализовать большие объемы солянокислых растворов невыгодно. Экономически правильнее использовать отходы, содержащие «солянку», повторно на производстве. Существует несколько таких возможностей, например: производство хлоридов определенных металлов или осуществление выделения чистого хлора.
Обезвреживанием и переработкой солянокислого раствора, как и других кислотных растворов, занимаются профессионалы. Кто предлагает подобного рода услуги? Обычно это компании, имеющие лицензию на утилизацию опасных отходов. Специалисты таких компаний обезвреживают агрессивные среды в соответствии со всеми требованиями техники безопасности.
Изготовление реактора попытка №2
Проблему с расплавлением реактора я решил заменив пластмасс на дерево. Из куска ОСБ я вырезал кругляш просверлил в нём всё также 3 отверстия два под электроды и один под отвод газов. Дополнил конструкцию также ещё 2 болтами что бы проще было подключать и отключать как клеммы так и электроды, плюсом также было что они повышали герметичность конструкции. Также для удобства я заменил трубу на более короткую и нанёс на низ деревянной пробки силиконовый герметик. Герметик я использовал как прокладку для герметичности.
Болты для удобства подключения
Болты для удобства подключения
Болты для удобства подключения
Теперь вроде не должен плавиться как я подумал в прицепе идея себя оправдала при испытании ни чего не расплавилось однако я упустил другой момент всё таки крышка прилегала не равномерно к банке и следовательно газ выходил из щелей так как не было достаточной герметичности. На скорую руку я постарался решить проблему обычными стяжками от части это помогло но это не решение проблемы.
Использование стяжек
Пришло время конструировать новый реактор не будем сдаваться и продолжим свои исследовательские опыты.
Доступные варианты замены паяльной кислоты
Для обработки железа, стали, никеля, чистой меди и их различных сплавов перед пайкой используют ортофосфорную кислоту, которую зачастую называют фосфорной.
Эта кислота не только удаляет образующиеся оксиды, но и создаёт защитный слой, что легко разрушается под воздействием высокой температуры жала паяльника.
Ну а самый простой и популярный в народе метод замены паяльной кислоты – обыкновенный аспирин.
Раствор аспирина делают, просто смешав таблетку аспирина в небольшом количестве воды, после чего смесь наносится на заготовку и производится пайка.
Также некоторые мастера вместо приготовления раствора просто посыпают рабочую поверхность растолчённой таблеткой аспирина.
Рекомендую следующее видео, где автор наглядно показывает процесс изготовления самодельной паяльной кислоты:
https://youtube.com/watch?v=OVQaK32aU1Y
Кислота как отход: химические свойства, класс опасности, потенциальный вред здоровью человека и окружающей среде
Вред экологии
Отходами от промышленного применениямогут быть испарения или соли тяжёлых металлов. Первые могут конденсироваться в слоях атмосферы и возвращаться как кислотные осадки, отравляющие всё живое.
Вторые через проникновение в водные ресурсы становятся настоящей отравой для рек, озёр.
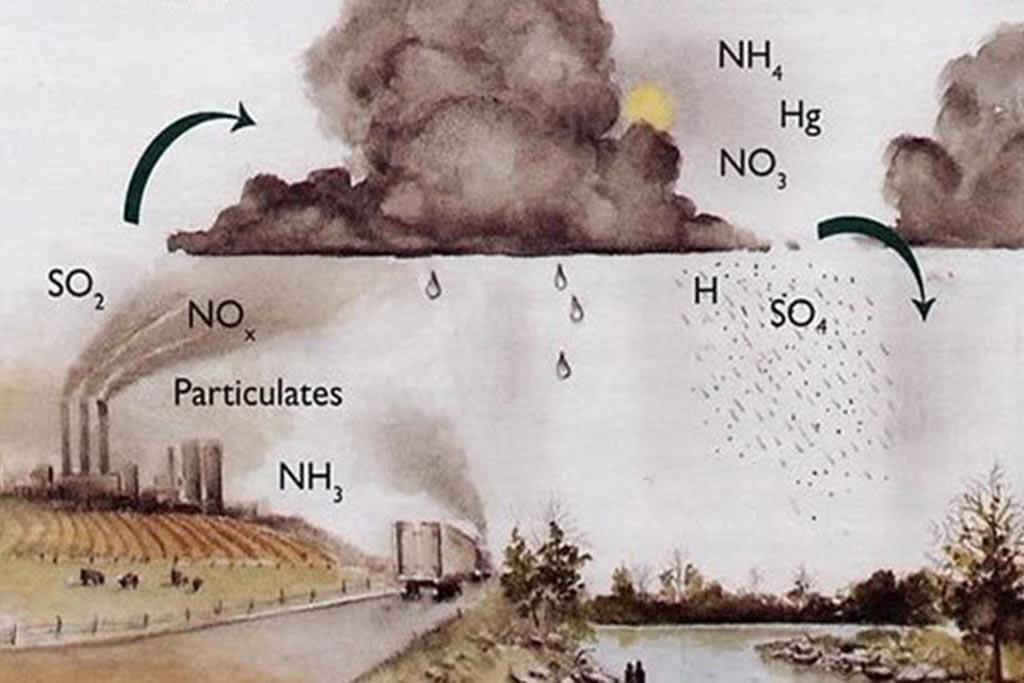 Кислотный дождь
Кислотный дождь
Опасность для людей
Кислоты относятся к повышенному классу опасности. Особенность концентрированного хлороводорода – образование паров при контакте с воздухом. Эти пары приводят к удушью, а также ожогам органов дыхания.
Азотная своими парами оказывает негативное воздействиена функционирование сердца.
Некоторые кислоты при своём «старении» становятся взрывоопасными. Взрыв пикриновой может произойти от обычного трения при открывании крышки ёмкости.
После того, как кислотные соединения были применены, требуется их хранение или утилизация. Хранить – опасно. Поэтому лучшим выходом является их переработка или уничтожение.
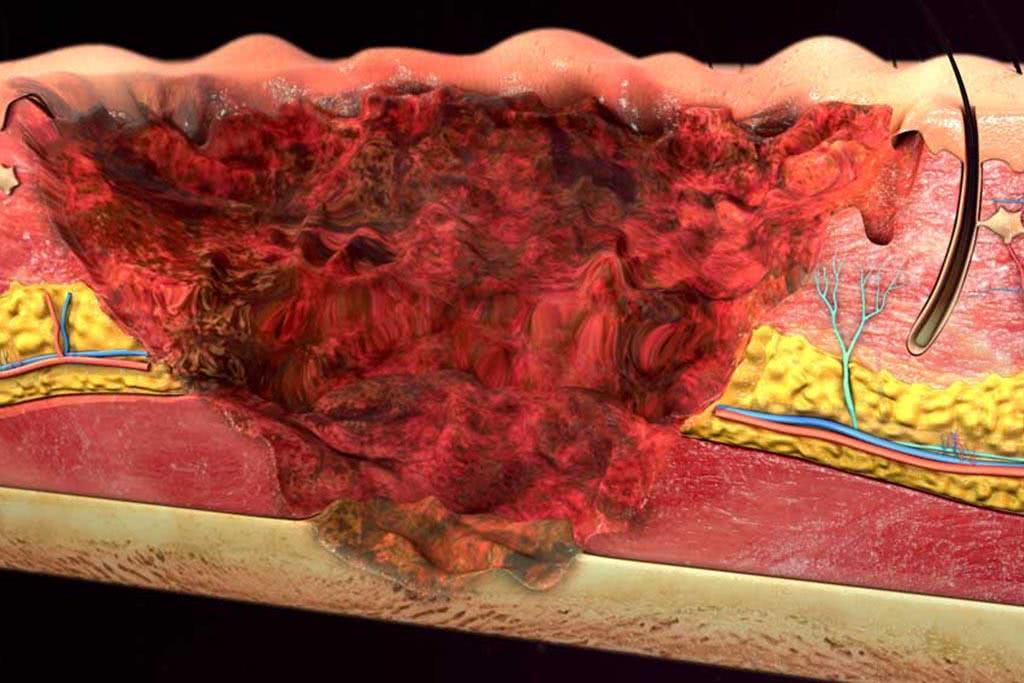 Кислотный ожог
Кислотный ожог
Причины появления засоров
Канализационная система перемещает сточные воды с большим содержанием органики и жиров. Они налипают на стенки тонким слоем, который постепенно нарастает и превращается в полноценный засор. Как правило, он располагается неподалеку от сливного отверстия кухонных раковин или других сантехнических приборов. Чаще всего от жировых наслоений страдает сифон, изгиб которого активно собирает на себя липкие и вязкие компоненты сточных вод.
Кроме этого, частой причиной становятся посторонние предметы, попадающие в канализацию. Здесь могут оказаться волосы, бумага, строительный мусор (песок, остатки клеевых растворов), женские прокладки и другие нежелательные компоненты. Они застревают в участках изгиба или сужения труб, становятся причиной образования постоянного засора. Никакие методы, кроме механической прочистки, результатов не дают.
На чугунных трубах встречаются случаи отслоения окалины с внутренней поверхности стенок. Она остается внутри и быстро обрастает жиром, задерживает мелкие частицы органики. Решением проблемы также станет механическая чистка труб.
Приготовление лимонной кислоты в домашних условиях

Процесс изготовления «Лимонки» дома, требует терпения и времени. Но пищевая добавка, изготовленная в домашних условиях, несколько отличается своим внешним видом от производственного аналога.
Приготовление «Лимонки»:
- Выжмите сок лимона. Для этого подойдет соковыжималка или можно воспользоваться простым методом – разрезав плод на половинки, выдавить сок руками.
- Подготовьте две посудины: одну глубокую, а вторую мелкую.
- В глубокую тару налейте воды. Она будет использоваться для создания водяной бани.
- Процедите сок через марлю и отделите от мякоти и косточек.
- Залейте в неглубокую посуду.
- Поставьте кастрюлю с водой на огонь и доведите содержимое до кипения.
- Установите мелкую посуду внутрь кастрюли.
- Выпаривайте до тех пор, пока жидкая часть сока не испарится, а на поверхности останутся лишь кристаллы.
Таким нехитрым способом, можно получить лимонную кислоту в домашних условиях, имеющую некоторые отличия от покупной продукции.
Получение кислоты в домашних условиях
Попробуем получить щёлочь или кислоту в домашних условиях с помощью подручных средств.
Конечно, полученный нами препарат не будет концентрированным (это достигается с помощью
специального оборудования), но характерные свойства кислоты обязательно будут заметны.
Наиболее простой способ получение кислоты в домашних условиях будет основан на электролизе какого-либо раствора, который диссоциирует с образованием сульфат-иона. Иным способом получить кислоту тоже можно, но это связано или с получением сернистого ангидрида, или других химических препаратов, которых может не оказаться, да и все они достаточно опасны, чтобы с ними работать дома.
Поэтому, получим, например, серную кислоту (разбавленную) из медного купороса. Та концентрация, которая получается из купороса — особо не опасна, к тому же, средств для её получения нужно немного.
Итак, для опыта нам необходим источник
тока (отлично подойдёт блок питания от 15 до 30 вольт). Анод (электрод подключаемый к плюсу)
будем брать графитовый, — чтобы не растворялся. Катод – лучше взять виде графитовой пластинки,
но можно также использовать медную фольгу.
Разведите раствор купороса опустите в него электроды. На катоде будем наблюдать выделение
бурого рыхлого вещества – это медь.
Что такое медный купорос? Это медь, растворённая в серной кислоте. Приготовьтесь периодически
вынимать катод » — » и очищать его от выделившейся на нём меди. Чем дольше продолжается опыт,
тем раствор нашего электролита становится всё более светлым – из него удаляется медь. Если
опустить наш индикатор в посветлевший раствор, то окраска изменится на алый цвет. Как-никак
серная кислота! Конечно, она сильно разбавленная, но всё же проявляет свои свойства.
Для того, чтобы более удостовериться в полученной кислоте возьмите пищевую соду и капните на неё
полученной кислотой, — при этом должно наблюдаться бурное выделение газа – это углекислый газ.
Серная кислота вступает в реакцию с пищевой содой, образуя при этом соль натрия (Na2SO4), воду и
пузырьки углекислого газа.
Задуманное получилось! Для некоторых веществ она слабовата (т.к. сильно разбавлена) и реакции с
ними Вы наблюдать не будете.
Конечно, можно увеличить концентрацию кислоты, если растворить в воде больше медного купороса
или выпариванием излишка воды в полученной кислоте. Последнее проделывать не рекомендую, т.к.
пары кислоты очень опасны.
- HCl — pH=1,0
- CCl3COOH — pH=1,2
- H2C2O2 — pH=1,3
- NaHSO4 — pH=1,4
- Винная кислота — pH=2,0
- Лимонная кислота — pH=2,1
- Молочная кислота — pH=2,4
- Салициловая кислота — pH=2,4
- Янтарная кислота — pH=2,7
- C6H5COOH — pH=2,8
- CH3COOH — pH=2,9
- NH4H2PO4 — pH=4,0
- H2S — pH=4,1
- NaH2PO4 — pH=4,5
- KH2PO4 — pH=4,7
- HCN — pH=5,1
- NH4Cl — pH=5,1
- H3BO3 — pH=5,3
- (NH4)2SO4 — pH=5,5
- Фенол — pH=5,5
- CaCO3 — pH=7,3
- (NH4)2HPO4 — pH=7,9
- C6H5COONa — pH=8,0
- NaHCO3 — pH=8,3
- CH3COONa — pH=8,9
- Na2HPO4 — pH=9,2
- Mg(OH)2 — pH=10,0
- KCN — pH=11,1
- NH3 — pH=11,3
- Na2CO3 — pH=11,6
- Na3PO4 — pH=12,0
- Ca(OH)2 — pH=12,4
- Na2SiO3 — pH=12,6
- K2S — pH=12,8
- NaOH — pH=13,0
Какая кислота кислее?!
Наверное, Вы когда-нибудь задавали вопрос «какая же из кислот более кислая ?!» «или какая из щелочей более едкая ?!»
На этот вопрос можно ответить, рассмотрев значения pH растворов кислот и щелочей. Кислот очень много, поэтому рассмотрим лишь самые основные.
Значение рН раствора зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Чем меньше значение pH раствора, тем кислота «кислее» и наоборот, чем больше значение pH раствора, тем более едкая щелочь!
Получается, что, если выпить концентрированный лимонный сок, кислотность желудочного сока… понизится !? Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.